3D‑печатные анатомические модели меняют подход к предоперационному планированию: они повышают точность вмешательств, сокращают время в операционной и улучшают обучение. В статье раскрываем технологический процесс от КТ/МРТ до печати, материалы и методы, бизнес‑возможности для российских компаний и практические рекомендации для внедрения в клиниках.
Что такое анатомические модели и зачем они нужны в хирургии
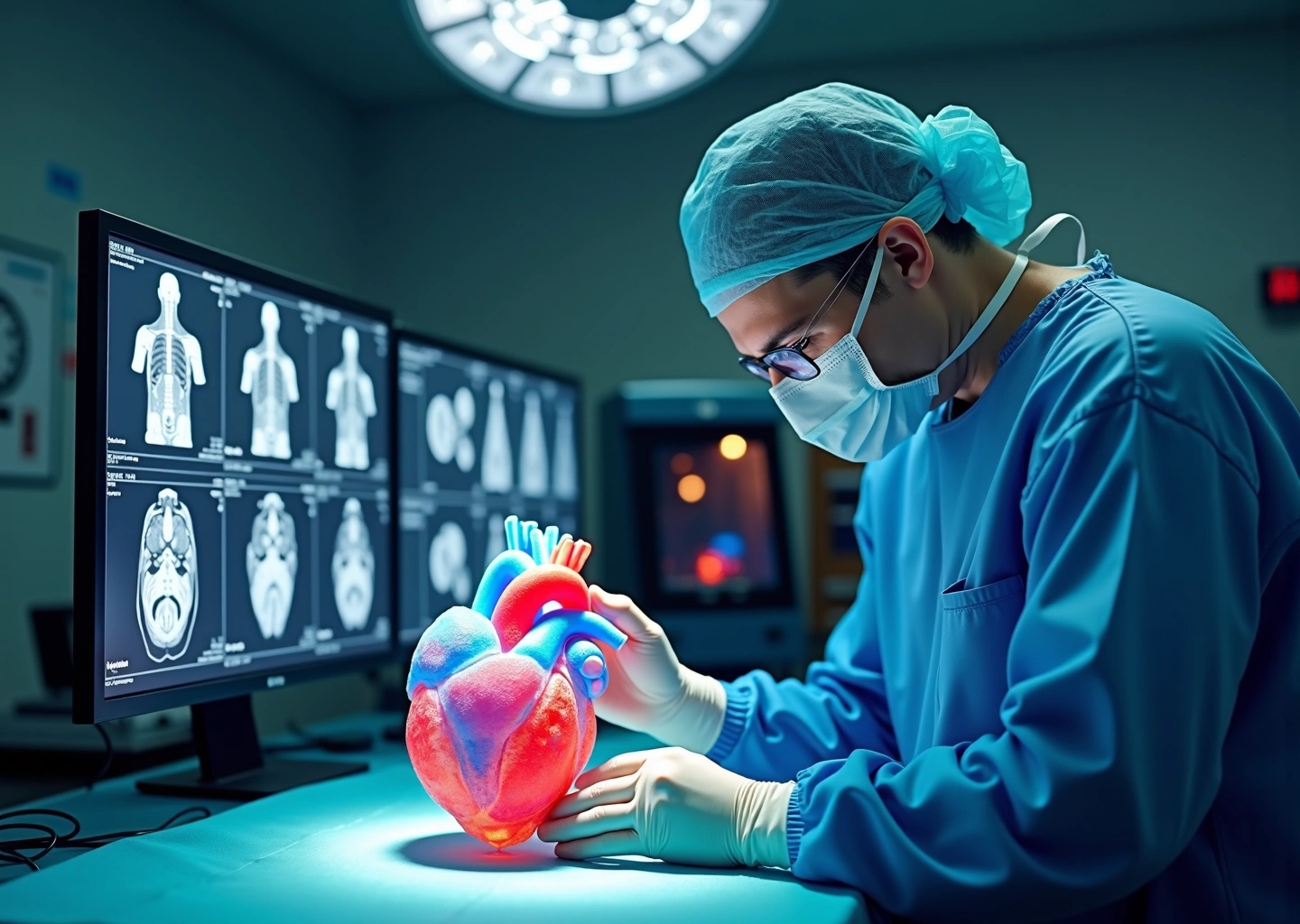
Представьте, что хирург может подержать в руках точную копию сердца пациента еще до того, как сделает первый разрез. Или изучить сложный перелом черепа со всех сторон, спланировав каждый шаг предстоящей операции. Это не сцена из будущего, а реальность, ставшая возможной благодаря 3D-печати. Анатомическая модель — это физический объект, созданный на основе данных компьютерной или магнитно-резонансной томографии (КТ/МРТ) пациента. Она с высокой точностью воспроизводит уникальное строение костей, органов или сосудистой системы конкретного человека. Это уже не просто трехмерное изображение на экране монитора, а осязаемый инструмент, который меняет подходы к хирургическому лечению.
Разновидности моделей напрямую зависят от клинической задачи.
- Твердые реплики костей. Чаще всего их печатают из прочных полимеров, например, полиамида. Такие модели идеально имитируют костную ткань. Они незаменимы в челюстно-лицевой хирургии для планирования реконструкций после травм или удаления опухолей. Хирург может заранее подогнать титановые пластины и имплантаты, что значительно сокращает время, пока пациент находится под наркозом. В ортопедии и травматологии на таких моделях отрабатывают коррекцию сложных переломов и деформаций.
- Гибкие имитации мягких тканей. Для их создания используют эластичные силиконоподобные материалы. Модель почки с опухолью, напечатанная из такого материала, позволяет хирургу тактильно оценить глубину залегания новообразования и его близость к крупным сосудам. Это особенно важно в онкохирургии, где цель — удалить опухоль полностью, сохранив при этом как можно больше здоровой ткани органа.
- Прозрачные модели сосудов. Их печатают из специальных фотополимеров, которые после обработки становятся прозрачными. В кардиохирургии и нейрохирургии это дает уникальную возможность увидеть сложную сеть артерий и вен изнутри. Хирург может детально изучить аневризму сосудов головного мозга или врожденный порок сердца у ребенка, выбрав самый безопасный путь для доступа. Часто такие модели делают многокомпонентными, окрашивая артерии и вены в разные цвета для лучшей наглядности.
Основное назначение таких моделей — это предоперационное планирование. Вместо того чтобы полагаться только на двухмерные срезы КТ, команда врачей может собраться вокруг физической копии и обсудить тактику вмешательства. Исследования, актуальные на 2025 год, показывают, что такой подход сокращает время операции в среднем на 15–30%. Например, в сложной нейрохирургической операции это может означать экономию целого часа, что напрямую снижает риски осложнений и кровопотери.
Другая важная функция — симуляция операции. Молодые хирурги и ординаторы получают возможность отработать сложные этапы вмешательства на реалистичной модели, а не на живом человеке. Это бесценный опыт, который повышает уверенность и оттачивает мануальные навыки. В педиатрии, где анатомия маленьких пациентов имеет свои особенности и не прощает ошибок, 3D-модели стали настоящим прорывом, особенно при коррекции врожденных пороков.
Не стоит забывать и о коммуникации с пациентом. Объяснить человеку суть предстоящей операции, показывая ему плоские черно-белые снимки, бывает очень сложно. Когда пациент держит в руках модель собственного органа и видит, что именно и как будет делать врач, уровень его доверия и спокойствия возрастает. Это помогает получить более осознанное согласие на операцию и снижает предоперационный стресс, по некоторым данным, до 35%.
Наибольший эффект от применения 3D-моделей сегодня наблюдается в нескольких ключевых направлениях.
- Челюстно-лицевая хирургия. Здесь точность планирования критична для восстановления не только функции, но и внешности пациента.
- Ортопедия и травматология. Модели помогают при сложных переломах таза, позвоночника и суставов.
- Кардиохирургия. Особенно при врожденных пороках сердца у детей, где анатомия уникальна и непредсказуема.
- Нейрохирургия. Для планирования операций на сосудах головного мозга и удаления опухолей в труднодоступных местах.
- Онкохирургия. Модели помогают точно определить границы опухоли и спланировать органосохраняющую операцию.
Конечно, чтобы модель была действительно полезным инструментом, а не просто сувениром, она должна соответствовать строгим критериям качества. Главный из них — анатомическая точность. Отклонение от реальных размеров, полученных с КТ или МРТ, не должно превышать долей миллиметра. Вторым критерием является повторяемость. Если для одного и того же пациента напечатать две модели, они должны быть абсолютно идентичны. Наконец, важна сопоставимость с исходной визуализацией. Врач должен быть уверен, что структура, которую он видит на модели, в точности соответствует тому, что он видел на DICOM-снимках. Обеспечение этих критериев — сложный технологический процесс, о котором мы поговорим в следующей главе.
Технологический процесс от изображения до готовой модели
Создание анатомической модели — это не просто нажатие кнопки «Печать». Это сложный, многоэтапный процесс, где на каждом шагу важна точность, экспертиза и правильный выбор инструментов. Давайте разберем весь путь от снимка на экране томографа до готового объекта, который хирург сможет взять в руки.
Шаг 1. Получение цифрового слепка пациента
Все начинается с медицинских изображений. Основой для любой 3D-модели служат данные компьютерной (КТ) или магнитно-резонансной (МРТ) томографии. Эти исследования создают серию послойных двумерных срезов тела пациента. Все эти срезы хранятся в стандартизированном формате DICOM (Digital Imaging and Communications in Medicine). Это, по сути, универсальный язык для медицинских изображений, который понимают и томографы, и специализированное программное обеспечение. Качество исходных данных критически важно: чем тоньше срезы и выше разрешение снимков, тем детальнее и точнее будет финальная модель. Для костных структур идеально подходит КТ, а для мягких тканей, сосудов и опухолей — МРТ, часто с контрастированием.
Шаг 2. Сегментация — искусство выделения нужного
Получив массив DICOM-файлов, который может состоять из сотен срезов, инженер или врач приступает к самому ответственному и трудоемкому этапу — сегментации. Это процесс, в ходе которого на каждом 2D-срезе вручную или полуавтоматически выделяются границы нужных анатомических структур. Представьте, что вам нужно обвести контуры почки, опухоли и проходящих рядом сосудов на нескольких сотнях изображений. Именно здесь цифровые данные превращаются в будущую трехмерную модель.
Для этого используется специализированное ПО. Выбор огромен, но условно его можно разделить на две категории:
- Свободные решения. Яркий пример — 3D Slicer. Это мощная платформа с открытым исходным кодом, популярная в академической и научной среде. Она бесплатна и обладает широким функционалом, но требует от пользователя глубоких технических знаний и времени на освоение.
- Коммерческие программные комплексы. Здесь золотым стандартом считается Materialise Mimics. Это сертифицированное медицинское ПО, которое предлагает не только продвинутые инструменты для ручной сегментации, но и автоматизированные алгоритмы на базе ИИ. Такие системы могут самостоятельно распознавать стандартные анатомические структуры, что значительно ускоряет процесс и снижает риск человеческой ошибки. Конечно, за такие возможности приходится платить, и стоимость лицензий может быть существенной.
Процесс сегментации занимает от 4 до 12 часов в зависимости от сложности случая. Ошибка на этом этапе приведет к созданию анатомически неверной модели, что сведет на нет всю ее ценность для хирурга.
Шаг 3. Экспорт и подготовка к печати
После того как все нужные структуры выделены, программа объединяет двумерные маски в единый трехмерный объект. Этот объект чаще всего экспортируется в формат STL (Stereolithography) — стандарт для 3D-печати, представляющий собой полигональную сетку, то есть поверхность, состоящую из тысяч маленьких треугольников.
Но полученный STL-файл еще не готов к печати. Он проходит этап подготовки, который включает:
- Ретопологию и исправление сетки. Автоматически сгенерированная сетка может содержать дефекты: разрывы, артефакты, лишние полигоны. Их необходимо исправить, чтобы модель была цельной и гладкой.
- Создание поддержек. Во время печати нависающие элементы модели (например, ветви сосудов или ребра) могут деформироваться под собственным весом. Чтобы этого избежать, программа-слайсер добавляет временные поддерживающие структуры, которые после печати удаляются.
- Настройка параметров печати. Модель нарезается на сотни или тысячи тончайших слоев, и для каждого слоя задаются параметры: скорость движения печатающей головки, температура, толщина слоя. От этих настроек напрямую зависит качество и время печати.
Шаг 4. Выбор технологии печати и материалов
Выбор принтера и материала зависит от клинической задачи. Не существует одной универсальной технологии, подходящей для всего.
Ключевое правило: технология подбирается под цель, а не наоборот. Для планирования резекции кости нужна прочность, а для анализа сосудистой сети — прозрачность и детализация.
- SLA (стереолитография) и PolyJet. Эти технологии идеально подходят для моделей, где важна высочайшая точность (до 16 микрон) и гладкая поверхность. Они работают с жидкими фотополимерами, которые затвердевают под действием УФ-излучения. Технология PolyJet, разработанная Stratasys, позволяет печатать многокомпонентные модели, комбинируя разные материалы в одном цикле. Например, можно напечатать почку из жесткого материала, опухоль внутри нее — из мягкого, а сосуды — из прозрачного. Это дает хирургу беспрецедентный уровень понимания анатомии.
- SLS (селективное лазерное спекание). Здесь используется лазер, который спекает частицы полимерного порошка (чаще всего полиамида). Модели получаются очень прочными, слегка шероховатыми, идеально подходящими для создания точных копий костей, на которых можно репетировать распилы, установку пластин и винтов.
- FDM (моделирование методом послойного наплавления). Самая доступная и распространенная технология, где модель создается путем выдавливания расплавленной нити пластика. FDM-принтеры отлично подходят для создания простых и прочных прототипов, но уступают SLA и SLS в детализации и точности.
- Печать гибкими материалами. Для имитации мягких тканей используются специальные фотополимеры или термопластичные эластомеры. Такие модели позволяют хирургам отрабатывать наложение швов, разрезы и ощутить тактильную разницу между здоровой тканью и патологическим образованием.
Материалы для медицинских моделей должны отвечать строгим требованиям. Если модель будет контактировать с пациентом (например, хирургический шаблон) или использоваться в стерильных условиях операционной, она должна быть изготовлена из биосовместимого материала (сертификация по стандартам ISO 10993, USP Class VI) и выдерживать стерилизацию (автоклавирование, гамма-облучение или обработку оксидом этилена).
Шаг 5. Постобработка, контроль качества и логистика
Напечатанная модель — это еще полуфабрикат. Ей предстоит постобработка: удаление поддержек, промывка в спирте (для SLA), очистка от порошка (для SLS), дополнительное УФ-отверждение для набора прочности. Иногда требуется шлифовка, покраска или сборка из нескольких частей.
Финальный и обязательный этап — проверка точности. Готовую физическую модель сравнивают с исходной цифровой, накладывая ее на DICOM-снимки. Отклонения не должны превышать долей миллиметра. Только после этого модель передается хирургу.
Весь цикл от получения снимков до готовой модели в российских реалиях занимает от 48 до 120 часов. Стоимость варьируется в широких пределах: простая костная модель может стоить 20–40 тысяч рублей, а сложная многокомпонентная модель сердца или печени с сосудами — до 150 тысяч рублей и выше.
Наконец, нельзя забывать о конфиденциальности. Работа с данными КТ и МРТ — это работа с персональными медицинскими данными пациента. Их хранение и передача должны строго соответствовать законодательству (в России это ФЗ-152 «О персональных данных»), что требует использования защищенных серверов, шифрования и строгого контроля доступа.
Внедрение в клинике и коммерческие модели для предпринимателей
Итак, технологический процесс от снимка до готовой модели нам понятен. Теперь перейдем к самому интересному для руководителей клиник и предпринимателей. Как превратить эту технологию в работающую систему и прибыльный бизнес в российских реалиях? Давайте разберем практические сценарии, бизнес-модели и юридические тонкости.
Сценарии внедрения в клинике
Существует три основных пути интеграции 3D-печати в медицинскую практику. Выбор зависит от размера клиники, потока пациентов и инвестиционных возможностей.
- Организация лаборатории при клинике. Это самый капиталоемкий, но и самый эффективный вариант для крупных федеральных центров, научно-исследовательских институтов и частных больниц с большим потоком сложных хирургических случаев. Вы получаете полный контроль над процессом, максимальную скорость изготовления моделей (что критично в экстренных случаях) и возможность развивать собственную научную базу. Инвестиции в стартовый пакет оборудования, ПО и обучение персонала начинаются от 3 миллионов рублей, но при активном использовании окупаемость достигается за 1.5–3 года.
- Сервис «под ключ» для больниц. Компромиссный вариант, набирающий популярность. Специализированная компания-партнер размещает свое оборудование и инженера непосредственно на территории клиники. Больница предоставляет помещение и доступ к заказам, а партнер берет на себя все технические аспекты, от обслуживания принтеров до сегментации снимков. Модель удобна тем, что не требует от клиники капитальных вложений и найма узкопрофильных специалистов, при этом модели создаются быстро и на месте.
- Аутсорсинговая модель. Самый доступный способ начать работу с 3D-моделями. Он идеально подходит для небольших клиник, частнопрактикующих хирургов или для тестирования технологии перед более серьезными инвестициями. Вы просто отправляете DICOM-файлы пациента в стороннюю компанию и получаете готовую модель с курьером через несколько дней. В России уже работает более 20 компаний, предлагающих такие услуги, что позволяет выбрать оптимального партнера по цене и качеству.
Детализация бизнес-модели для предпринимателей
Если вы решили запустить собственный сервис по созданию анатомических моделей, важно четко понимать структуру доходов и расходов.
Структура затрат
- Первоначальные инвестиции. Основная статья расходов. Сюда входит покупка 3D-принтера (SLA или PolyJet для высокой точности, от 2 млн рублей), мощного компьютера и лицензионного программного обеспечения для сегментации (например, Mimics, от 500 тыс. рублей).
- Расходные материалы. Фотополимеры, порошки, растворители для постобработки. Себестоимость материалов для одной модели колеблется от 5 000 до 20 000 рублей.
- Сотрудники. Вам понадобится как минимум один инженер-моделист, владеющий медицинским ПО. Его зарплата в Москве составляет от 80 000 до 150 000 рублей. На начальном этапе его функции может выполнять сам предприниматель после прохождения обучения.
- Аренда и коммунальные платежи. Для небольшой лаборатории достаточно помещения 15–20 кв.м. с хорошей вентиляцией.
Источники дохода
- Изготовление анатомических моделей. Основной продукт. Ценообразование зависит от сложности, размера, материала и срочности.
- Услуги 3D-моделирования. Иногда клинике нужна только цифровая 3D-модель для виртуального планирования, без физического объекта.
- Создание хирургических шаблонов. Это более сложное и дорогое изделие, которое используется непосредственно в операции для точного позиционирования инструментов или имплантов.
- Обучение и консультации. Вы можете обучать хирургов и ординаторов основам работы с 3D-моделями, сегментации и планированию.
Примерное ценообразование на российском рынке в 2025 году
- Простая одноцветная модель кости (череп, таз): 20 000 – 40 000 рублей.
- Сложная модель с сосудистой сетью (прозрачный материал): 50 000 – 90 000 рублей.
- Многокомпонентная модель с имитацией мягких тканей (гибкие материалы): 70 000 – 150 000 рублей.
- Хирургический шаблон для челюстно-лицевой хирургии: 40 000 – 70 000 рублей.
Сотрудничество с клиниками и доказательство эффективности
Главный аргумент для любой клиники это экономика. Вы должны доказать, что ваша услуга не просто «инновационная игрушка», а инструмент, который экономит деньги. Оперируйте цифрами. Исследования и практика российских клиник показывают, что использование 3D-моделей сокращает время операции на 15–30%. Каждая минута в операционной стоит дорого (аренда, работа бригады, анестезия). Экономия 30–60 минут на сложной операции уже окупает стоимость модели. Второй важный показатель это снижение числа реопераций и осложнений на 10–20%. Это прямая экономия на повторных госпитализациях и лечении.
Начинайте сотрудничество с пилотных проектов. Предложите ведущему хирургу клиники бесплатно или с большой скидкой сделать несколько моделей для его самых сложных случаев. Соберите отзывы, зафиксируйте результаты (время операции, кровопотеря, результат) и представьте их главному врачу в виде убедительного кейса.
Сертификация и юридические аспекты
Вопрос регулирования в России все еще находится в стадии активного развития. Важно понимать разницу.
- Анатомические модели для планирования. Если модель используется только для визуализации и планирования вне тела пациента, она не считается медицинским изделием и не требует обязательной регистрации в Росздравнадзоре. Достаточно внутреннего контроля качества.
- Хирургические шаблоны и импланты. Если ваше изделие контактирует с тканями пациента во время операции или вживляется в организм, оно подлежит обязательной государственной регистрации как медицинское изделие. Это долгий и дорогой процесс. Для выхода на международные рынки потребуется сертификация по стандарту ISO 13485.
Юридическая сторона. Всегда заключайте подробный договор с клиникой. В нем должны быть прописаны:
- Ответственность. Четко разграничьте, кто несет ответственность за ошибку на каком этапе. Ошибка сегментации — ответственность инженера. Неправильная интерпретация модели хирургом — ответственность врача.
- Защита данных. Работа с DICOM-файлами подпадает под действие ФЗ-152 «О персональных данных». Обеспечьте безопасное хранение и передачу данных, используйте шифрование и получите от пациента информированное согласие на обработку его данных для создания модели.
Наконец, при выборе оборудования и партнеров ориентируйтесь на компании, имеющие опыт работы именно в медицинской сфере. Изучайте кейсы, общайтесь с их клиентами. Начинайте с узкой ниши, например, с челюстно-лицевой хирургии или ортопедии, отработайте процессы и только потом масштабируйте бизнес, предлагая услуги для кардиохирургии или онкологии. Маркетинг в этой сфере строится на экспертности. Участвуйте в медицинских конференциях, публикуйте статьи, ведите профессиональный блог. Ваша главная аудитория это хирурги, и говорить с ними нужно на языке клинической пользы и экономической выгоды.
Часто задаваемые вопросы и ответы
Часто задаваемые вопросы и ответы
Когда речь заходит о внедрении новой технологии, особенно в такой консервативной сфере, как медицина, возникает множество вопросов. Это нормально. И у хирургов, и у руководителей клиник, и у предпринимателей, которые видят в этом новую нишу, есть свои сомнения и потребности. Я собрала самые частые из них, чтобы дать короткие и практичные ответы, которые помогут вам сориентироваться.
- Насколько точна модель относительно данных КТ/МРТ?
Точность современных моделей очень высока. В среднем отклонение от исходных цифровых данных составляет 0,1–0,3 мм, что для большинства хирургических задач более чем достаточно. При использовании передовых технологий печати, таких как фотополимерная (SLA) или струйная (PolyJet), можно достичь детализации до 16 микрон. Однако важно помнить, что итоговая точность зависит не только от принтера, но и от качества исходных снимков (толщины среза КТ) и, что критически важно, от квалификации специалиста, выполняющего сегментацию. Экспертный совет: всегда запрашивайте у исполнителя отчет о валидации, где напечатанная модель сравнивается с исходной 3D-реконструкцией.
- Сколько времени занимает весь цикл от снимка до готовой модели?
В российских реалиях на 2025 год средний срок составляет от 48 до 72 часов. Этот процесс делится на три основных этапа:
- Сегментация и моделирование. Превращение DICOM-снимков в 3D-файл. Занимает от 4 до 12 часов в зависимости от сложности анатомической области.
- 3D-печать. Непосредственно процесс печати может длиться от 12 до 72 часов. Время зависит от размера модели, выбранной технологии и разрешения.
- Постобработка. Удаление поддержек, очистка, полировка, иногда покраска. Это еще 2–8 часов.
При наличии отлаженного процесса и современного оборудования в клинике или лаборатории возможно выполнение срочных заказов за 24 часа, но это, как правило, увеличивает стоимость.
- Сколько стоит модель и от чего зависит цена?
Стоимость анатомической модели в России варьируется в широком диапазоне — от 20 000 до 150 000 рублей и выше. Цена формируется из нескольких ключевых факторов:
- Сложность сегментации. Выделить кость черепа проще и быстрее, чем разветвленную сосудистую сеть печени.
- Размер и объем модели. Больше модель — больше расходных материалов и времени на печать.
- Материал. Простой жесткий пластик (FDM) дешевле. Многокомпонентные модели, имитирующие кости, мягкие ткани и сосуды (PolyJet), будут стоить значительно дороже.
- Технология печати. SLA и PolyJet обеспечивают высокую точность, но и стоимость их выше по сравнению с FDM или SLS.
- Срочность заказа.
Для примера, простая модель кости для травматолога может стоить 20-40 тыс. рублей, а комплексная модель сердца с сосудами и клапанами для кардиохирурга — 90-150 тыс. рублей.
- Какие материалы безопасны для контакта с тканями и можно ли стерилизовать модель?
Да, многие модели можно стерилизовать, но здесь важно различать их назначение. Если модель используется только для предоперационного планирования и не будет контактировать с пациентом в стерильной зоне, требования к материалу минимальны. Если же модель или хирургический шаблон планируется использовать интраоперационно, материал должен быть биосовместимым (сертифицированным по стандартам ISO 10993, USP Class VI) и выдерживать стерилизацию. Основные методы стерилизации — автоклавирование (паром), газовая стерилизация (этиленоксидом) или гамма-облучение. Важно: всегда уточняйте у производителя модели, какой метод стерилизации подходит для конкретного материала, чтобы не повредить изделие.
- Нужно ли отдельное согласие пациента и как хранить DICOM-файлы?
Да, получение письменного информированного согласия пациента — обязательная юридическая и этическая норма. В нем должно быть указано, что его анонимизированные медицинские данные (снимки КТ/МРТ) будут использованы для создания физической модели с целью планирования операции. Хранение DICOM-файлов и производных 3D-моделей подпадает под действие Федерального закона № 152-ФЗ «О персональных данных». Это означает, что данные должны храниться на защищенных серверах с ограниченным доступом, а их передача третьим лицам (например, аутсорсинговой лаборатории) должна осуществляться по защищенным каналам и регулироваться договором о конфиденциальности.
- Кто несёт ответственность при ошибке в модели?
Это сложный вопрос, ответ на который должен быть четко прописан в договоре между клиникой и лабораторией 3D-печати. Ответственность распределяется. Клиника (или лечащий врач) отвечает за качество исходных данных (КТ/МРТ) и корректность постановки задачи. Исполнитель (инженер или компания) отвечает за точность преобразования этих данных в физический объект. Однако важно понимать: анатомическая модель — это вспомогательный инструмент, а не прямое руководство к действию. Окончательное клиническое решение всегда остается за хирургом. Именно он, опираясь на свой опыт, данные обследования и модель, принимает решение в операционной. Наличие модели не отменяет его профессиональной ответственности.
- Когда модель не даёт пользы и её не стоит заказывать?
3D-модель не является панацеей. Её заказ нецелесообразен в рутинных, стандартных операциях, где анатомия пациента предсказуема, а хирургическая тактика отработана до мелочей. Например, при неосложненном удалении аппендикса или стандартном лечении простого перелома. Модель приносит максимальную пользу в следующих случаях:
- Сложная или редкая анатомическая вариация.
- Онкология, когда нужно точно определить границы опухоли и её отношение к сосудам и нервам.
- Реконструктивные операции, где требуется точное планирование и подгонка имплантов.
- Врожденные аномалии, особенно в педиатрии.
- Обучение молодых специалистов и объяснение хода операции пациенту.
- Можно ли печатать импланты и где границы?
Печать анатомических моделей и печать индивидуальных имплантов — это два совершенно разных мира с точки зрения технологий, материалов и, главное, регулирования. Анатомические модели для планирования — это, по сути, наглядные пособия. Импланты, которые устанавливаются в тело пациента на длительный срок, — это медицинские изделия высокого (чаще всего 3-го) класса риска. Их можно печатать из биосовместимых материалов (титан, PEEK), но для этого требуется производство, сертифицированное по стандарту ISO 13485, а само изделие должно пройти длительную и дорогостоящую процедуру государственной регистрации в Росздравнадзоре, включая технические и клинические испытания. Поэтому, если лаборатория предлагает вам «напечатать имплант», это повод для серьезной проверки ее лицензий и сертификатов.
- Какие стандарты и сертификация применимы в РФ?
Регуляторная среда в России активно формируется. На 2025 год ситуация следующая:
- Модели для планирования (не контактирующие с пациентом). Часто не требуют обязательной регистрации как медицинское изделие. Однако для серьезной работы с клиниками рекомендуется внедрить систему менеджмента качества, например, по стандарту ISO 13485.
- Хирургические шаблоны и модели для интраоперационного использования. Должны быть зарегистрированы в Росздравнадзоре как медицинские изделия (обычно 1 или 2а класс риска). Материалы должны иметь подтверждение биосовместимости.
- Индивидуальные импланты. Требуют полной процедуры регистрации как медицинское изделие 3-го класса риска.
Рекомендация для бизнеса: перед выходом на рынок проконсультируйтесь с экспертами по регистрации медицинских изделий, чтобы правильно классифицировать вашу продукцию и услуги.
- Как научиться сегментировать и где пройти обучение?
Освоение сегментации — ключевой этап. Есть несколько путей. Для старта и понимания основ можно использовать бесплатное программное обеспечение с открытым кодом, такое как 3D Slicer или InVesalius. В сети много видеоуроков и сообществ, посвященных работе в них. Для профессиональной деятельности потребуется специализированное ПО (например, Materialise Mimics, Simpleware ScanIP), которое стоит дорого, но предлагает более мощный и автоматизированный инструментарий. Обучение можно пройти на коммерческих курсах от дистрибьюторов этого ПО, а также в некоторых передовых вузах и научных центрах России, где появляются программы дополнительного образования на стыке медицины и инженерии. Средний срок полноценного обучения с практикой занимает 3–6 месяцев.
Выводы и практические рекомендации
Подводя итог, можно с уверенностью сказать, что 3D-печать анатомических моделей перестала быть экзотической технологией и превратилась в рабочий инструмент хирурга. Её ценность не в красивой визуализации, а в ощутимых клинических и экономических результатах. Модели оправданы не всегда, а в конкретных, чётко очерченных случаях. В первую очередь, это сложные и нетипичные операции, где стандартные протоколы не работают. Онкология с её необходимостью точно определить границы опухоли, челюстно-лицевая хирургия с реконструкцией костных дефектов, нейрохирургия с её ювелирной работой вблизи жизненно важных структур и детская кардиохирургия с уникальной анатомией маленьких пациентов — вот главные области применения.
Ключевая выгода для российских клиник — это повышение предсказуемости и безопасности операций. Когда хирург держит в руках точную копию органа пациента, он может заранее продумать тактику, подобрать инструменты и отработать самые сложные этапы. Это позволяет сократить время операции в среднем на 15–30%, что подтверждается многочисленными исследованиями. А чем меньше пациент находится под наркозом, тем ниже риски осложнений и быстрее восстановление. Экономический эффект складывается из нескольких факторов: сокращение операционного времени, уменьшение расхода дорогостоящих материалов и снижение числа повторных вмешательств, которое может достигать 10–20%. Для предпринимателей это растущий рынок. По прогнозам, к концу 2025 года его глобальный объём превысит 600 миллионов долларов. В России, где многие клиники ещё не имеют собственных 3D-лабораторий, открывается ниша для сервисных компаний, предлагающих печать моделей «под ключ».
Критически важный этап внедрения — это отладка процесса сегментации, то есть преобразования снимков КТ или МРТ в цифровую 3D-модель. Именно здесь закладывается точность будущего изделия. Ошибки на этом этапе сведут на нет все преимущества технологии. Поэтому квалификация инженера или врача, занимающегося сегментацией, имеет первостепенное значение.
Практический чек-лист для старта
Для тех, кто готов сделать первый шаг, мы подготовили два сценария.
Для клиники (пилотный проект)
- Оборудование. Для начала достаточно одного фотополимерного принтера (SLA или PolyJet) для печати высокоточных и прозрачных моделей. Бюджет на стартовый комплект оборудования, включая промывочную станцию и камеру для полимеризации, составит около 3 млн рублей.
- Персонал. Минимально необходим один специалист — клинический инженер или врач с навыками работы в программах вроде 3D Slicer или Mimics. Его обучение займёт от 3 до 6 месяцев.
- Сроки и бюджет. Пилотный проект на 3–5 клинических случаях займёт 2–3 месяца. Бюджет, включая зарплату специалиста и расходные материалы (около 500 тыс. рублей), составит примерно 1–1,5 млн рублей. Полный цикл от получения DICOM-снимков до готовой модели в российских реалиях занимает от 48 до 120 часов.
Для стартапа (коммерческий сервис)
- Оборудование. Стоит рассмотреть покупку двух принтеров разного типа, например, SLA для детализации и SLS для печати прочных костных моделей из полиамида. Это расширит спектр предлагаемых услуг.
- Персонал. Команда должна состоять как минимум из двух человек: инженер-технолог, отвечающий за производство, и менеджер по работе с клиентами для взаимодействия с клиниками.
- Бизнес-модель. Основной доход — продажа готовых моделей. Средняя стоимость простой костной модели на рынке составляет 20 000–40 000 рублей, а сложной многокомпонентной — до 150 000 рублей. Первым шагом должен стать поиск клиники-партнёра для отработки процессов и создания портфолио.
Валидация качества и измерение результата (KPI)
Чтобы технология приносила реальную пользу, а не была просто модной игрушкой, важно контролировать качество и измерять эффективность.
- Валидация модели. Точность проверяется путём цифрового наложения готовой 3D-модели на исходные КТ/МРТ-снимки. Допустимое отклонение не должно превышать 0,3 мм. Визуальный осмотр хирургом также является обязательным этапом.
- Ключевые показатели эффективности (KPI).
- Клинические: процент снижения времени операции, снижение частоты интраоперационных осложнений, уменьшение количества повторных операций.
- Экономические: окупаемость инвестиций (ROI), которая для лаборатории в клинике составляет в среднем 1,5–3 года, снижение стоимости лечения одного случая.
- Пациентские: уровень удовлетворённости пациентов, который, по данным исследований, повышается на 25% благодаря лучшей информированности.
Краткий взгляд в будущее
Технологии не стоят на месте, и уже сегодня мы видим контуры медицины завтрашнего дня.
- Интеграция с ИИ. Искусственный интеллект уже помогает автоматизировать и ускорять процесс сегментации, сокращая его с нескольких часов до десятков минут. В ближайшие годы нейросети станут стандартным инструментом в этой области.
- Биопечать и индивидуальные импланты. Следующий шаг — переход от печати моделей к печати функциональных тканей и органов. Пока это больше область научных исследований, но печать индивидуальных имплантов из титана и биосовместимых полимеров уже стала реальностью в российских клиниках.
Начать путь к внедрению 3D-печати проще, чем кажется. Первым шагом может стать заказ нескольких моделей для сложных случаев у сторонней компании. Это позволит оценить пользу технологии без капитальных вложений. Для поиска партнёров и подрядчиков стоит посетить профильные мероприятия, например, ежегодный форум «3D-печать в медицине» в Москве, или обратиться в профессиональные ассоциации, которые начинают появляться в России. Технология уже здесь, и те, кто освоит её сегодня, получат неоспоримое преимущество завтра.
Источники
- Анализ рынка 3D-печатных хирургических моделей — Глобальные продажи 3D-печатных хирургических моделей оцениваются в 607.5 млн долларов США в 2025 году и, как ожидается, достигнут значения U3D Printed Surgical …
- 3D-печать в медицине — Хирурги все чаще используют 3D-печатные модели органов и костных структур для планирования сложных операций. Эти модели, основанные на …
- Прогнозы на 2022 год: 3D-печать в медицине меняет … — Ссылаясь на данные, согласно которым рынок трехмерной печати достигнет $5,1 млрд к 2026 году, Shapeways пишет, что ожидаемый рост будет продолж …
- Технологические особенности и опыт 3D-печати … — Помимо имплантатов 3D-печать позволяет производить анатомические модели костей, органов и сосудов, которые используются в планировании операций и в обучении.
- От анатомических моделей к хирургическим шаблонам — Используя технологии SLA и SLS 3D-печати, клинические инженеры могут в короткие сроки создавать анатомические модели для сложных хирургических …
- тема научной статьи по медицинским наукам и … — Автор: ЗА Кахаров · 2023 · Цитируется: 2 — 3D-печатные модели костей многообещающе точны в морфологии, включая морфологию переломов костей. Цена технологии 3D-печати в настоящее время достигла разумного …
- Опыт применения 3D-моделирования и 3D-печати при … — Приведен пример использования 3D-моделирования 3D-печати при диагностике и выборе хирургического подхода лечения стриктуры гепатикохоледоха.
- Ближайшие и отдаленные перспективы 3D-printing в … — Автор: ЕВ Кудрявцева · 2021 · Цитируется: 1 — Кроме этого, следует информировать акушеров-гинекологов и хирургов о возможности печати на 3D-принтере хирургических инструментов по индивидуальному дизайну.
- Application of 3D printing in urology — В заключение авторы отметили, что применение 3D-напечатанных моделей почки значительно улучшает результаты проводимых оперативных вмешательств за счет точного …
- Применение 3D-печати в медицине: инновации в … — Зажимы, щипцы, гемостаты могут быть 3D-напечатаны для конкретной хирургической операции в необходимом количестве и быстро. Такие предметы …